MRD技术系列解析(一):单点突变灵敏度
MRD技术系列解析(一):单点突变灵敏度

前言
今天是《MRD技术系列解析》科普专题的第二讲,我们在上一篇《浅谈炙手可热的MRD技术》中提到评估MRD技术性能的几个关键指标,其中“单点突变灵敏度”是非常重要的一个因素。它的具体概念是什么?它和ctDNA检测灵敏度是一回事吗?应该如何认识不同MRD产品所宣传的灵敏度?哪些因素会对单点突变灵敏度指标产生影响?这篇文章将为您逐一解析。
浅谈炙手可热的MRD技术
MRD技术系列解析(一):单点突变灵敏度
MRD技术系列解析(二):监测突变数量
MRD技术系列解析(三):背景噪音干扰
如何快速识别MRD产品性能
单点突变灵敏度的概念
单点突变灵敏度即突变LoD,是指检测系统能够稳定检出的最低突变丰度。这里所谓的稳定检出在统计学的概念中就是95%检出,也就是当突变的丰度为最低突变丰度时,我们重复检测100次,超过95次都能把这个突变检测出来。
单点突变灵敏度(突变LoD)是评价MRD检测技术的关键指标,但是在实际临床应用中,很多公司会把突变LoD和ctDNA LoD混为一谈,产生一系列误解。我们通过一个案例进一步剖析突变LoD和ctDNA LoD这两个指标的差异。
假设一个检测Panel在检测范围内共覆盖了100个肿瘤特有突变,突变LoD要求在对应的丰度下,我们能稳定检出这所有的100个肿瘤特有突变,不能有任何一个突变漏检;而ctDNA LoD只要在对应的丰度下检出其中1个突变(可以漏检其他99个突变),就能判断为ctDNA阳性。
通过以上案例我们不难发现,突变LoD是最严格的要求,是评价检测技术的关键指标,目前国内外各种技术路径能实现的突变LoD都在0.1%左右[1];而ctDNA LoD比突变LoD要来得宽松,由于可监测多个突变,因此远低于突变LoD,根据突变数量不同在0.01%-0.005%左右。市场上不同MRD产品在宣传灵敏度时采用了不同的概念,采用ctDNA LoD概念的产品往往展示的灵敏度数据更佳。因此在评估时,需要首先明确产品宣传具体采用的是突变LoD还是ctDNA LoD。
影响单点突变灵敏度的因素有哪些?
在临床实践中,MRD检测单点突变灵敏度高意味着能更早、更准确地发现肿瘤释放的分子信号,有助于临床对患者进行更精细地风险分层,进而匹配治疗,最大程度避免假阴性评估,以免高危患者错失及时干预的机会。因此单点突变灵敏度对于疾病诊断和治疗决策意义重大,究竟哪些因素可以影响单点突变灵敏度,我们一起来梳理一下。
1、样本采集量
巧妇难为无米之炊,单点突变灵敏度也受限于类似问题——采血量。肿瘤释放到血液中的ctDNA较少,因此有限的采血量,仅能获得少量ctDNA,进而影响突变检测灵敏度。我们可以通过简单计算来直观地学习一下。单个细胞的基因组约6.6pg,一个细胞有两套人类基因(hGE),这就意味着一套hGE约重3.3pg。当患者采血量为10ml时,可分离4ml血浆,而每毫升血浆可以提取5-10ng ctDNA,因此最终我们可分离得到约30ng ctDNA。结合hGE重量换算后,10ml采血量大概有10000个hGE,来源于5000个细胞。这5000个细胞就是所有的检测对象,如果其中有肿瘤细胞,我们的检测技术足够灵敏,可以实现较高的检测灵敏度,但如果这5000个细胞里没有任何肿瘤细胞,那技术再灵敏,也无法检出肿瘤信号。因此想要进一步提高检测灵敏度只能加大采血量,增加样本多样性。由此可见,样本采集量会对单点突变灵敏度产生较大影响。
2、样本质量
此外,包括肿瘤细胞占比、起始样本的完整性和多样性等样本质量因素也会影响检测灵敏度[2]。这几个指标很好理解:首先,如果在血液中,肿瘤细胞来源的ctDNA占游离DNA(cfDNA)的比例较低,那么我们试图在少量肿瘤细胞释放的ctDNA中寻找特定突变就会变得异常困难,灵敏度自然会降低;其次,一旦样本DNA破碎或片段化严重,也可能直接导致某些特定位置突变无法被有效检出;最后,起始样本所包含的DNA多样性也是影响灵敏度的关键。DNA多样性,即存在的突变信息是否丰富,多样性高意味着某种特定突变就越可能存在于待检样本内,因此也就更有机会被检出,反之则可能被遗漏造成假阴性结果。当然,除了起始样本多样性,测序过程中的损耗也可能造成多样性损失进而降低灵敏度(图1) [3]。整体来看,样本质量是MRD单点突变灵敏度技术实现的限制因素,这不仅涉及到临床样本采集环节,还关联到测序流程中的效率能否进一步提升。
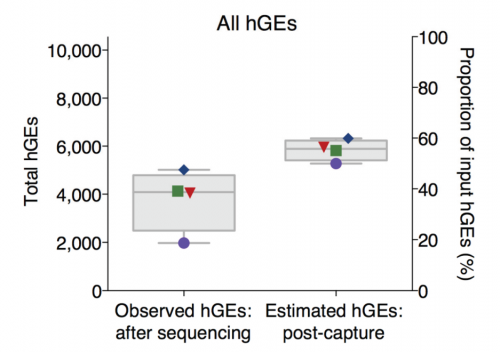
图1. NGS检测流程中多样性损失超过60%
3、测序深度
针对晚期转移性肿瘤用药指导,基于NGS的ctDNA测序深度通常选择在3000-5000X。而为了实现在ctDNA低释放前提下检测MRD,测序深度通常需要10,000X或更高。理论上测序深度越深,对于低频突变的检测能力就越强,MRD灵敏度可相应提升(图2) [4],然而加深测序深度却不能无限提高灵敏度。首先,MRD检测需要综合考虑灵敏度和特异性的平衡。由于测序误差的存在,测序深度越深,引入的随机错误会越多,这意味着测序深度超出一定范围将会严重影响检测准确性;其次,提高测序深度亦会增加数据处理的复杂性,对应MRD状态的判断也会愈加困难。因此,测序深度的选择还需结合实际情况,深度一味加大并不是提升灵敏度的最佳方式。
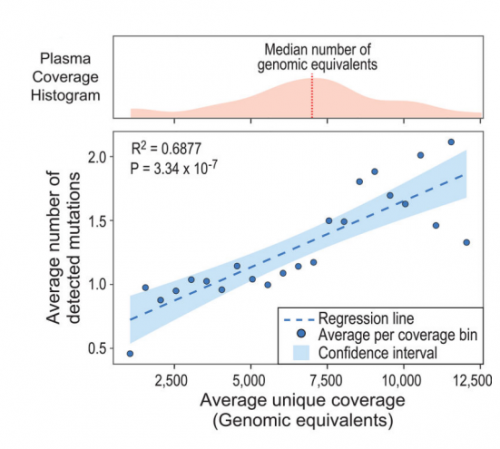
图2. 测序深度与所能检测到的肿瘤突变数量的相关性
4、背景噪音
另外,降低背景噪音也是提高单点突变灵敏度的重要方法。在NGS检测过程中,可能会产生各种噪音,例如PCR扩增错误、测序仪器误差、样本处理过程中的损伤和污染等。不同的位点,在不同的变异方向有不同的噪音水平,一刀切的固定阈值会损失灵敏度与特异性。此外,克隆性造血带来的生物学噪音,也会对检测信号的判读产生重要影响。这些噪音可能会干扰低频率突变的检测,降低检测的灵敏度与特异性。有效去除背景噪音是在保证特异性的前提下提高单点突变灵敏度的重要因素。
考虑到以上因素对单点突变灵敏度的影响,世和基因推出的术宁UltraMRD监测产品,采用自主研发的ATG-seq®技术,在全面降噪的基础上结合30000X超高深度测序,可实现低丰度突变的稳定检出;此外,公司基于超万例全外显子数据库,精选2365基因设计MRD监测Panel,万分之一低丰度突变仍可稳定检出(LoD低至0.01%)。该产品兼具灵敏度高、性能稳定等优势,在达到共识要求的基础上,能全面满足临床诊疗评估及科研探索的需求。
结语
随着精准诊疗技术的持续发展,MRD检测以其高灵敏度和准确性为我们提供了一个窥视肿瘤微观世界的窗口。这种能在单基因水平上检测到极低比例肿瘤分子信号的手段,不仅能够帮助我们精细化患者的预后分层进而匹配最恰当的治疗方案,亦能提前发现肿瘤复发,为患者创造及时干预的宝贵机会,实现真正意义上的精准治疗。《MRD技术系列解析》科普专题持续更新中,下一篇我们将对影响MRD性能的另一关键因素——监测突变数量进行深度解析,敬请期待。
参考文献
[1] A personalized, tumor-informed approach to detect molecular residual disease with high sensitivity and specificity. SignateraTM. Residual disease test (MRD).
[2] Valeria Ferla, Elena Antonini, Tommaso Perini, et al. Minimal residual disease detection by next-generation sequencing in multiple myeloma: Promise and challenges for response-adapted therapy.Front Oncol. 2022 Aug 16;12:932852. doi: 10.3389/fonc.2022.932852.
[3] Aaron M Newman, Alexander F Lovejoy, Daniel M Klass, et al. Integrated digital error suppression for improved detection of circulating tumor DNA. Nat Biotechnol. 2016 May;34(5):547-555. doi: 10.1038/nbt.3520.
[4] Asaf Zviran , Rafael C Schulman, Minita Shah, et al. Genome-wide cell-free DNA mutational integration enables ultra-sensitive cancer monitoring.Nat Med. 2020 Jul;26(7):1114-1124. doi: 10.1038/s41591-020-0915-3.
发表评论




暂时没有评论,来抢沙发吧~